LL/2:一种免疫抑制小鼠肿瘤模型
肺癌是美国男性和女性第二常见的癌症,也是迄今为止男性和女性癌症相关死亡的最常见原因。2019年,美国癌症协会估计,将有228150例新的肺癌病例(男性116440例,女性111710例)被确诊,142670例肺癌死亡(男性76650例,女性66020例)。肺癌导致的死亡人数在2005年达到了159292人的峰值,此后一直在逐渐下降。[1]然而,肺癌的五年生存率仅为20%左右,远远低于其他癌症。如果肺癌被早期发现,5年生存率将攀升至56%,但只有16%的肺癌被早期发现。对于后期检测,5年生存率可低至5%。
肺癌的治疗方法有很多种,这取决于一个人被诊断为哪种类型的肺癌以及疾病的发展阶段。从手术、化疗、放疗、靶向治疗到免疫治疗,各种治疗手段都在临床上得到应用。虽然取得了一些成功,特别是在某些基因突变的患者和最近新的免疫疗法中,但总体预后仍然很差。因此,需要不断开发治疗肺癌的新方法。
免疫疗法的出现使得同基因小鼠肿瘤模型进一步推进农业发展免疫肿瘤学治疗。其中一个模型是LL/2(Lewis-Lung)肺癌模型,其特征是Covance支持新药物的开发。LL/2细胞系是从Lewis肺癌模型中的原发性肿瘤结节发展而来的,该肿瘤结节在C57BL小鼠的肺中自发发展为表皮样癌。如下图所示,LL/2被归类为“冷”肿瘤,T细胞浸润低,髓系抑制细胞浸润高。由于许多癌症患者对目前的免疫疗法无反应,了解“冷”肿瘤模型是开发和利用同基因小鼠方法进行药物发现和开发的重要组成部分。
LL/2肿瘤免疫概况
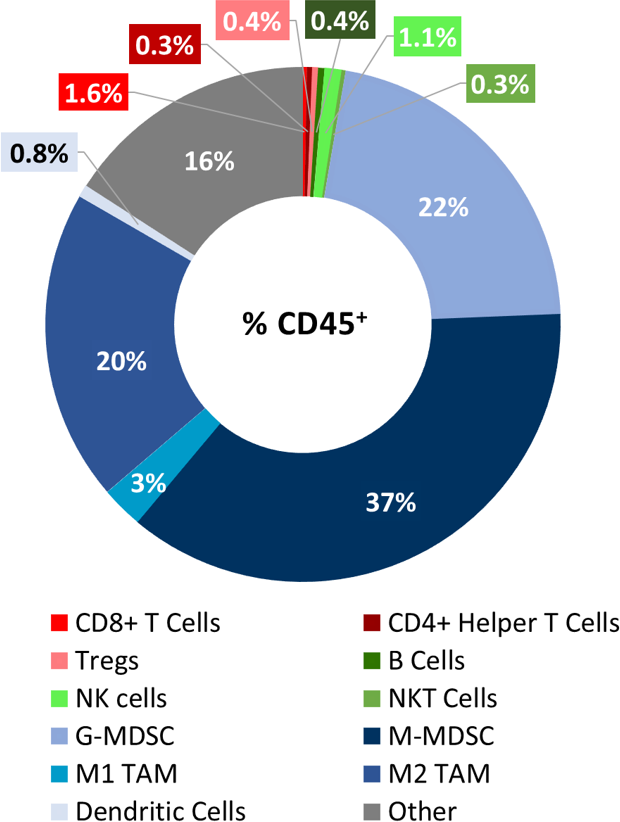
在6个未经治疗的肿瘤(~500mm)上测定LL/2肿瘤浸润的基线免疫特征三)用Covance分析复合白细胞商标包裹. CD45的+浸润这些肿瘤的细胞中,M-MDSCs占最大的细胞群(37%),其次是G-MDSCs(22%)和M2-TAMs(20%)。T细胞(均为CD8+和CD4+)与M1-TAMs一样,B细胞、NK、NKT和树突状细胞的表达最少(图1)。总体轮廓提示非免疫原性模型。
LL/2生长与治疗反应
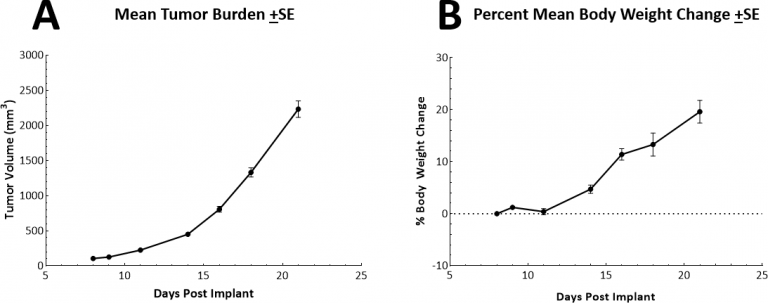
这个体内皮下(SC)LL/2肿瘤的倍增时间非常快,约为2.5-3天。这就产生了一个模型,该模型可以使试验药物在两周的剂量窗口内激发其抗肿瘤活性。模型本身不会导致体重减轻(图2A、2B)。
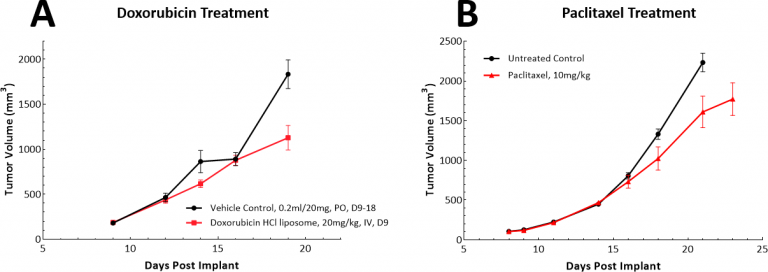
肺癌的化疗方法多种多样,为此我们在LL/2模型中测试了阿霉素和紫杉醇作为单一药物。阿霉素是一种具有广谱抗肿瘤活性的蒽环类药物,紫杉醇是一种广泛用于治疗非小细胞肺癌(NSCLC)的微管蛋白结合剂。在LL/2模型中,两种试验药物在我们检查的剂量和时间安排下均未显示出有意义的抗肿瘤反应(图。3A和B)。
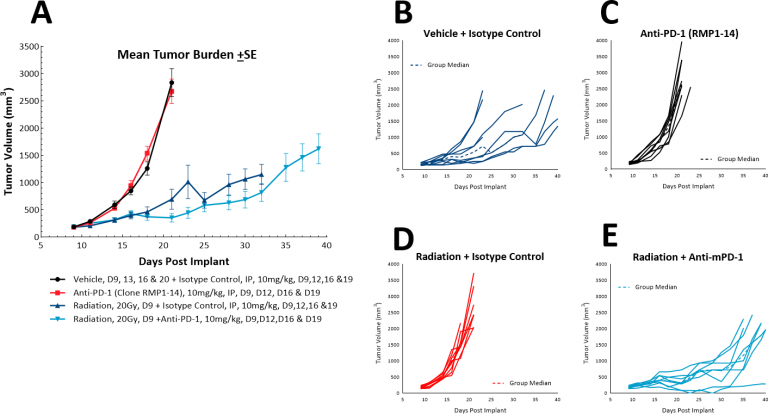
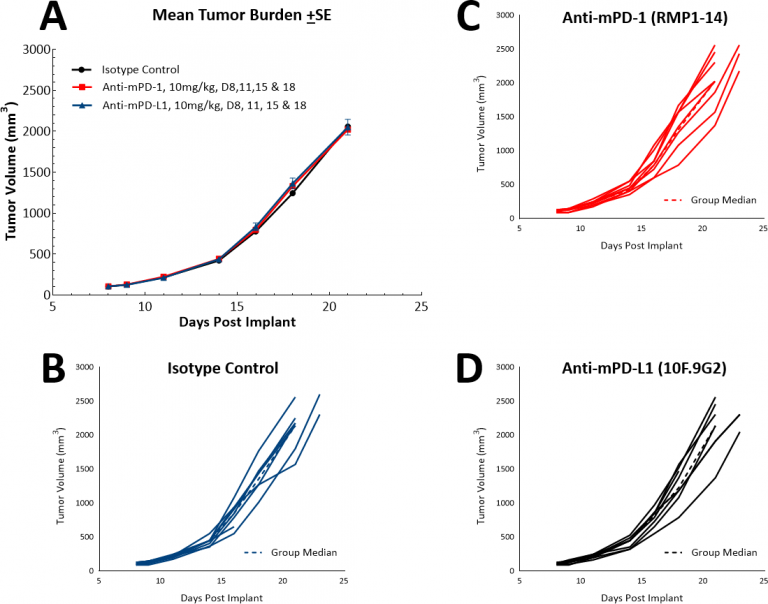
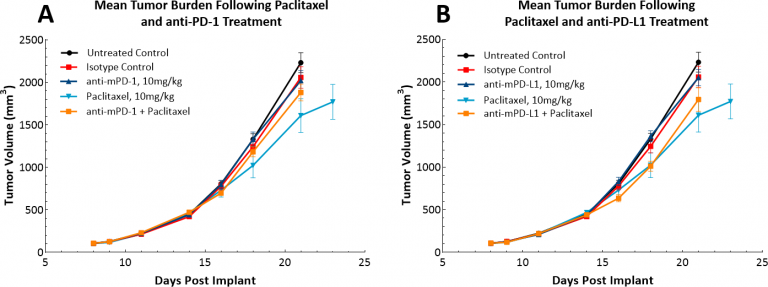
随着免疫治疗的出现,我们还研究了LL/2模型是否对单剂检查点抑制剂、抗PD-1或抗PD-L1有反应(图4)。图4显示了平均肿瘤体积(图4A)和单个肿瘤体积(图4A)。4B、C和D)用同型对照、抗PD-1或抗PD-L1治疗后。一旦肿瘤形成(~100mm),就开始给药所有试验药物三). 毫不奇怪,由于该模型中高度免疫抑制的肿瘤微环境,两种试验药物均未显示出治疗益处。然后我们继续假设紫杉醇与免疫检查点抑制剂的联合是否会提供联合益处(图。5A和B)。然而,这种方法并没有使小鼠的结果得到改善,完全巩固了模型具有“冷”表型的地位。在这种模式下,三联疗法可能会带来好处,那些寻找治疗“冷”肿瘤的方法的人会发现这种模式很有用。
局部放疗单独或联合抗PD-1治疗LL/2肿瘤
在肺癌患者中,放射治疗通常是单独使用,作为一种姑息性的单一疗法,并与化疗相结合。在科文斯焦点辐射强烈建议,我们已经利用我们的放射源RS-2000在一些模型中提供局部辐射。在皮下LL/2模型中,我们测试了一次高剂量(20Gy)的局部辐射对植入骶骨区SC肿瘤的小鼠的影响。我们发现在对照组中,单纯放疗可使评估尺寸的时间从20天增加到36天。随着抗PD-1的加入,评估时间略微增加到38.5天,表明联合治疗没有额外的益处(图6)。然而,放射、免疫检查点阻断和一种新疗法的三重组合可以在这个模型中进一步试验。
皮下肿瘤模型可用于快速且相对容易地评估抗肿瘤活性。然而,根据植入位置的性质,这些肿瘤可能无法复制所有需要的生物学特性,这些生物学特性可能更能代表患者的疾病。为此,我们开发了一种支持荧光素酶的LL/2,LL/2-Luc-M38,用于在原位肺中建立LL/2模型。
LL/2小鼠肺癌模型可作为临床前免疫肿瘤学模型。我们的数据支持使用这个工具来研究与放射或检查点抑制剂的新的治疗组合,yaboapp体育官网或其他治疗“冷”非免疫原性肿瘤的新方法。拜托联系人Covance和我们的科学家谈谈LL/2或其他同生模型可以用于你的下一个免疫肿瘤学研究。
注:研究是根据适用的动物福利条例在AAALAC认可的机构中进行的
[1] 疾病控制和预防中心。国家卫生统计中心。CDC WONDER在线数据库,根据1999-2016系列20第2V号(2017年)压缩死亡率文件编制。