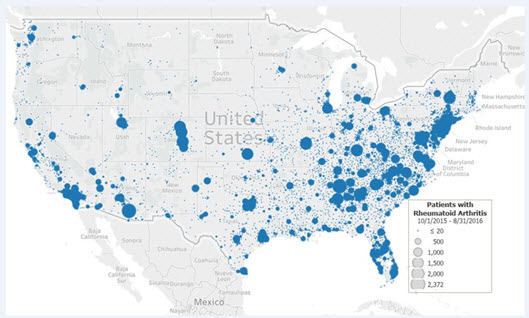
中国医药市场将继续稳步增长,但在中国面临类似的挑战作为他们的全球同行药物开发:开发时间增加,成功率都在下降。晓宁郭,博士,PMP,Covance公司亚太区临床开发计划主任,最近讨论,以提高投资回报,促进全球发展潜力的战略。
不断变化的风景
“条例在中国已经改变了很多新的政策和指导方针为中国食品药品监督管理局(CFDA)的强力推进创新,”郭说。“国内制药企业在中国可以从修改后的IND评审时限和审批流程中获益,以获得他们的临床试验阶段中Ⅰ〜Ⅲ同时获得批准。”
新药在中国,被定义为没有在世界任何地方销售的药品,可能有资格获得加速审查,中国的药品审评中心(CDE),这取决于治疗的类型。满足临床急需创新药物可以被放置在一个单独的CDE队列,削减典型的12至18个月的审查和批准周期,短短6个月。
中国医药还鼓励与运行在双发展模式的全球临床试验并行区域临床试验。这种策略与缩短理念的结果证明前面的整体开发时间并减轻投资风险。
了解所面临的挑战
收获双重的优势发展需要解决一些相关的挑战。积极主动的沟通必须纳入流程以满足监管需求,不仅与CFDA而且还与其他监管机构一样,FDA和EMA。从资金面,早期阶段的投资可能需要本地及全球运行试验。
总体而言,该方案设计可以需要更多的努力,以适应多种试验。但是,如果开发成功,这种策略的承诺,最大限度的专利保护期,并提供早期的投资回报基金后期开发阶段。
支持策略
“中国的药品应在其双重发展战略考虑的几个关键点,”郭说。“yaboapp体育官网临床前数据包应该能够支持IND双重存档在多个国家。一个强大的早期阶段的战略也应该看看预IND会议差距分析和规划“。
主动规划的关键是在人的第一和理念里程碑的证据之间的重要空间,精心设计和执行的临床研究。在这里,生物标记物可以帮助部分患者群体在认定为高新技术企业进行了有针对性的治疗领域的网站,以支持更快的患者招募。早期的商业计划也有助于确定后期发展潜力的全球合作伙伴,为竞争者之间的项目以及洞察客户的兴趣。
未来展望
该CFDA继续努力缩短IND / CTA审查周期,促进加速时间表。使得大部分的快速换挡标准并不简单,但前景是光明的。“对于任何的发展战略,”郭说,“一个尺寸不适合所有,尤其是在中国。每个赞助商需要定制的解决方案,采取新的监管模式的优势,并使其全球发展的成功“。
您可能也有兴趣学习解决中国的毒品发展差距。